
Gamme dentaire greffons
PHOENIX® & PHOENIX DBM


TBF Génie Tissulaire est une Banque de Tissus autorisée par l'ANSM, créée en 1992 et implantée près de Lyon (France), TBF offre une gamme complète de substituts osseux pour répondre aux besoins cliniques de praticiens spécialisés en implantologie et en chirurgie maxillo-faciale.
L'utilisation de greffes osseuses d'origine humaine, minéralisées et spongieuses, issues de donneurs vivants, traitées par un procédé hautement sécurisé et éprouvé, offre une solution idéale pour la reconstruction osseuse.
Les allogreffes osseuses minéralisées PHOENIX® disposent d'un recul clinique de plus de 170.000 implantations sur plus de 27 ans. Elles présentent toutes les garanties de sécurité et d'efficacité.

La gamme PHOENIX est désormais complétée par une gamme d'allogreffes osseuses déminéralisées F-PHOENIX DBM (BMP et collagène physiologiques) permettant d'associer ostéoconduction et ostéoinduction.
INNOVATION TBF !
De plus, leur commande est pratique puisqu'une simple prescription médicale nominative permet d'être livré dès le lendemain.
TBF Génie Tissulaire met en œuvre un traitement spécifique d’inactivation virale, de délipidation, de lyophilisation et une radiostérilisation proposant toutes les garanties possibles d'innocuité.
La production est effectuée en zones à atmosphère contrôlée de classes ISO6 & ISO7.
Les étapes de la transformation sont les suivantes :
• Découpe et élimination du cartilage et de l’os cortical de la tête fémorale pour permettre une bonne pénétration des solvants.
• Inactivation des virus et des prions : une alternance de traitements chimiques (bains de lavage et de rinçage) et mécaniques (découpe, fraisage et lavage sous haute pression) permet de nettoyer les travées osseuses et d’éliminer les parties scléreuses ou trop fragiles de l’os, ainsi que les parties molles et les insertions ligamentaires. Les solvants chimiques utilisés sont l’éthanol et le chloroforme pour la délipidation, le peroxyde d’hydrogène et l’hypochlorite de sodium. Ce dernier bain à 2% de chlore actif permet de se prémunir contre les prions : cette étape permet une inactivation totale des ATNC (agents transmissibles non conventionnels), comme le décrit l’instruction applicable au 1er janvier 2012 de la Direction Générale de la Santé (DGS). A l’issue du traitement, différents tests ont montré un tissu osseux intact, des taux de solvants résiduels quasi inexistants et un taux de lipides inférieur à 5 %.
• Lyophilisation ou cryo-sublimation afin de déshydrater le tissu osseux en profondeur de façon reproductible permettant de garantir une conservation à long terme, à température ambiante, des caractéristiques du tissu osseux.
• Conditionnement sous vide des copeaux et des poudres.
• Radio stérilisation gamma entre 25 et 32 kGy, validée selon la norme ISO 11137.
Ce procédé a pour finalité de nettoyer les travées osseuses et d’inactiver par des solvants chimiques les micro-organismes potentiels.
Cette inactivation a été démontrée par l’Institut Pasteur-Texcell sur des virus particulièrement résistants.
La certification ISO 9001 garantit une reproductibilité du procédé PHOENIX® grâce au système d’assurance qualité.
Plusieurs étapes de contrôle sont effectuées au cours du traitement et chaque greffon est contrôlé individuellement avant libération.
Le greffon PHOENIX® est issu de têtes fémorales prélevées sur des donneurs vivants lors d'une arthroplastie de hanche.
La sélection clinique des donneurs est réalisée par le chirurgien orthopédiste en France.
Un échantillon de sang est prélevé simultanément au prélèvement de la tête fémorale pour le dépistage réglementaire d’éventuelles maladies transmissibles. Les analyses sérologiques sont réalisées par un laboratoire d’analyses indépendant.
Le recueil est organisé grâce à une logistique souple et performante développée à l’échelon national dans le respect des Bonnes Pratiques françaises de Tissus édictées par l’Agence de la Biomédecine (ex-Établissement Français des Greffes) et le respect de la loi Bioéthique.
La sélection est ensuite réalisée d’après les critères cliniques et biologiques issus des règles de sécurité sanitaire.
La traçabilité du tissu est assurée par un numéro d’identification unique attribué lors du prélèvement et conservé jusqu’à l’implantation du greffon PHOENIX®.
Le greffon osseux PHOENIX® est caractérisé par sa sécurité, sa facilité de conservation et d’utilisation, et son efficacité clinique prouvée et publiée.
Plus de 150 établissements de santé français sont aujourd'hui partenaires de TBF pour l'activité de recueil de têtes fémorales.
TBF Génie Tissulaire met en œuvre un traitement spécifique d’inactivation virale, de délipidation, de lyophilisation et une radiostérilisation proposant toutes les garanties possibles d'innocuité.
La production est effectuée en zones à atmosphère contrôlée de classes ISO6 & ISO7.
Les étapes de la transformation sont les suivantes :
• Découpe et élimination du cartilage et de l’os cortical de la tête fémorale pour permettre une bonne pénétration des solvants.
• Inactivation des virus et des prions : une alternance de traitements chimiques (bains de lavage et de rinçage) et mécaniques (découpe, fraisage et lavage sous haute pression) permet de nettoyer les travées osseuses et d’éliminer les parties scléreuses ou trop fragiles de l’os, ainsi que les parties molles et les insertions ligamentaires. Les solvants chimiques utilisés sont l’éthanol et le chloroforme pour la délipidation, le peroxyde d’hydrogène et l’hypochlorite de sodium. Ce dernier bain à 2% de chlore actif permet de se prémunir contre les prions : cette étape permet une inactivation totale des ATNC (agents transmissibles non conventionnels), comme le décrit l’instruction applicable au 1er janvier 2012 de la Direction Générale de la Santé (DGS). A l’issue du traitement, différents tests ont montré un tissu osseux intact, des taux de solvants résiduels quasi inexistants et un taux de lipides inférieur à 5 %.
• Lyophilisation ou cryo-sublimation afin de déshydrater le tissu osseux en profondeur de façon reproductible permettant de garantir une conservation à long terme, à température ambiante, des caractéristiques du tissu osseux.
• Conditionnement sous vide des copeaux et des poudres.
• Radio stérilisation gamma entre 25 et 32 kGy, validée selon la norme ISO 11137.
Ce procédé a pour finalité de nettoyer les travées osseuses et d’inactiver par des solvants chimiques les micro-organismes potentiels.
Cette inactivation a été démontrée par l’Institut Pasteur-Texcell sur des virus particulièrement résistants.
La certification ISO 9001 garantit une reproductibilité du procédé PHOENIX® grâce au système d’assurance qualité.
Plusieurs étapes de contrôle sont effectuées au cours du traitement et chaque greffon est contrôlé individuellement avant libération.
• L. Venet, M. Perriat, P. Jaby, T. Fortin ;
Intérêt de l'imagerie pour les greffes d'apposition allogéniques par tunnelisation
L'information dentaire, 2015.
• M. Isidori, T. Fortin ;
Etapes cliniques d'une reconstruction osseuse sous-sinusienne à l'aide de bouchons osseux impactés par voie crestale
Implant, 2014-20, 343-350.
• M. Perriat, C. Medard, C. Chavrier ;
Recherche d’une chirurgie implantaire à moindre invasivité, A propos d’un cas complexe d’édentement maxillaire 1ère partie : phase chirurgicale préimplantaire
Implant, vol 10 n°2, 2004.
• M. Brunel, C.Chavrier ;
Greffes d'apposition mandibulaires postérieures verticales par blocs osseux d'origine buccale
Implant, volume 9, Numéro 2 -2003.
• M. Perriat, C. Chavrier ;
Comblement sous-sinusien par la technique de cloisonnement à l’aide de greffon d’os cortical allogénique,
Implant, vol 8 n°2, 2002.
• S. Delpech ;
Descellement cotyloidien traité par allogreffe lyophilisée A propos de 25 cas, Thèse pour le doctorat en Médecine, Université de Picardie Jules Verne, Faculté de médecine d’Amiens, 2004, n°51.
• F. Borrione ;
Utilisation des greffes osseuses au cours des reprises de P.T.H. pour descellement,
Implantologie, fév 2004: 23-31.
• J.Caton, S.Eyrard, L.Barnouin ;
Suivi à 5 ans d'une banque de tissus osseux et de plus de 25 000 greffons impantés
Revue de Chirurgie Orthopédique et réparatrice de l'appareil moteur, vol.89 Octobre 2003
• C.Savornin, M.Caltran, P.Le Couteur, J-J. Jouan, P.Deroche, J-F Vinceneux, L .Barnouin ;
Reconstruction acétabulaire par allogreffe lors des reprises de prothède de hanche
médecine et armée, 2002, 30,3
• C.Savornin, M.Caltran, P.Le Couteur, J-J. Jouan, P.Deroche, J-F Vinceneux, L .Barnouin ;
Use of freeze-dried bone allografts in revision total hip arthroplasty, European Journal Orthopaedic Surgery Traumatology , 2002, 12:186-191.
• Barnouin L. ;
Les enjeux réglementaires d’une banque de tissus osseux,
La lettre de la stomatologie, n°14, 2002.
• Circulaire n° DGS/5C/dhos/Eé/2001/138 du 14 Mars 2001 relative aux précautions à observer lors de soins en vue de réduire les risques de transmission d’agents transmissibles non conventionnels.
NOR : MESP0130089C.
• Perriat M., Chavrier C. ;
Reconstruction osseuse implantaire à l’aide de greffons d’os allogénique,
Implant, vol 6 n°3, 2000.
• Batail R., Bruyère Garnier K., Rumelhart C. ;
Mechanical behaviour of human cancellous bone. Microbending of single trabeculae,
Archives of physiology and biochemistry, 1999.
• Bruyère-Granier K., Dumas R., Rumelhart C., Arlot M.E ;
Mechanical caracterization in shear of human femoral cancellous bone : torsion and shear tests,
Medical Engineering and Physics, 1999.
• Institut Pasteur Texcell ;
Etude de l’inactivation virale au cours d’un procédé de préparation de greffons osseux d’origine humaine.
Rapports 91/02/5144/01-A1 et 91/02/5144/02-A1, Paris, 1995.
• Mitton D. ;
Evaluation des propriétés mécaniques de greffons osseux d’origine humaine, lyophilisés et radiostérilisés,
DEA de GBM, INSA Lyon, 1994.
• F. Jolivot ;
Optimisation du volume osseux préimplantaire dans le secteur antérieur maxillaire: greffe autogène versus allogénique, Thèse pour le DE de docteur en chirurgie dentaire, Université C Bernard LYON1, U.F.R. d’odontologie, 2005, n°2005LYO1D048.
• Bardonnet R. ;
Evaluation dans un modèle poliovirus de l’inactivation virale lors de la préparation des greffons osseux d’origine humaine.
DES de pharmacie spécialisée (N°41-94), Lyon, 1994.
Autorisation de «Banque de tissus et procédés» n° BT/16/M/001 obtenue en janvier 2001 et reconduite régulièrement : obligatoire pour les activités de transformation, conservation, distribution et cession de tissus utilisés à des fins thérapeutiques.
• Sélection clinique des patients donneurs par les chirurgiens orthopédistes suivant le formulaire de l'Agence de la Biomédecine (anciennement Etablissement Français des Greffes) et aseptie du prélèvement.
• Sélection biologique effectuée sous la responsabilité d’un laboratoire de biologie agréé, indépendant. Un dépistage systématique recherche les infections par les virus HIV 1 & 2, HTLV, les hépatites B et C, la syphilis.
• Processus d’inactivation des virus résistants, validé par l’Institut Pasteur Texcell.
• Inactivation des prions, selon la circulaire en application depuis 2001.
• Radiostérilisation des greffons PHOENIX® selon la norme ISO 11137 (anciennement EN552)
• Maîtrise de la traçabilité du don à la pose : Entrées dans la base de donnée de TBF des fiches d’implantation retournées par les praticiens
• Biocompatibilité et sécurité des greffons PHOENIX® démontrées et validées par des organismes scientifiques reconnus : Biomatech, CNRS, Institut Pasteur-Texcell, LSEH, LMSo.
Les allogreffes PHOENIX sont constituées d'os allogénique. Elles offrent les propriétés de micro et macroporosité physiologiques naturelles de l’os spongieux humain.
Elles sont constituées d'os minéralisé et délipidé, permettant la colonisation immédiate des cellules et vaisseaux du patient pour une ostéointégration rapide.
Ces qualités ont été démontrées par TBF au cours d'une étude multicentrique, l'efficacité clinique est confirmée par les utilisateurs des greffons depuis 1994.
Greffons osseux PHOENIX®
Poudre d'os spongieux PHOENIX®
Poudre d'os cortico-spongieux PHOENIX®
Blocs d'os spongieux PHOENIX®
Copeaux d'os spongieux PHOENIX®
Lamelles d'os cortico-spongieux PHOENIX®
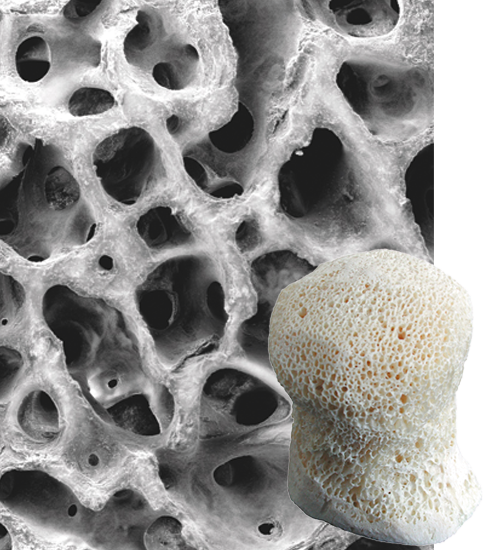
Greffons osseux
TBF Génie Tissulaire met en œuvre un traitement spécifique d’inactivation virale, de délipidation, de lyophilisation et une radiostérilisation proposant toutes les garanties possibles d'innocuité.
La production est effectuée en zones à atmosphère contrôlée de classes ISO6 & ISO7.
Les étapes de la transformation sont les suivantes :
• Découpe et élimination du cartilage et de l’os cortical de la tête fémorale pour permettre une bonne pénétration des solvants.
• Inactivation des virus et des prions : une alternance de traitements chimiques (bains de lavage et de rinçage) et mécaniques (découpe, fraisage et lavage sous haute pression) permet de nettoyer les travées osseuses et d’éliminer les parties scléreuses ou trop fragiles de l’os, ainsi que les parties molles et les insertions ligamentaires. Les solvants chimiques utilisés sont l’éthanol et le chloroforme pour la délipidation, le peroxyde d’hydrogène et l’hypochlorite de sodium. Ce dernier bain à 2% de chlore actif permet de se prémunir contre les prions : cette étape permet une inactivation totale des ATNC (agents transmissibles non conventionnels), comme le décrit l’instruction applicable au 1er janvier 2012 de la Direction Générale de la Santé (DGS). A l’issue du traitement, différents tests ont montré un tissu osseux intact, des taux de solvants résiduels quasi inexistants et un taux de lipides inférieur à 5 %.
• Lyophilisation ou cryo-sublimation afin de déshydrater le tissu osseux en profondeur de façon reproductible permettant de garantir une conservation à long terme, à température ambiante, des caractéristiques du tissu osseux.
• Conditionnement sous vide des copeaux et des poudres.
• Radio stérilisation gamma entre 25 et 32 kGy, validée selon la norme ISO 11137.
Ce procédé a pour finalité de nettoyer les travées osseuses et d’inactiver par des solvants chimiques les micro-organismes potentiels.
Cette inactivation a été démontrée par l’Institut Pasteur-Texcell sur des virus particulièrement résistants.
La certification ISO 9001 garantit une reproductibilité du procédé PHOENIX® grâce au système d’assurance qualité.
Plusieurs étapes de contrôle sont effectuées au cours du traitement et chaque greffon est contrôlé individuellement avant libération.
Le greffon PHOENIX® est issu de têtes fémorales prélevées sur des donneurs vivants lors d'une arthroplastie de hanche.
La sélection clinique des donneurs est réalisée par le chirurgien orthopédiste en France.
Un échantillon de sang est prélevé simultanément au prélèvement de la tête fémorale pour le dépistage réglementaire d’éventuelles maladies transmissibles. Les analyses sérologiques sont réalisées par un laboratoire d’analyses indépendant.
Le recueil est organisé grâce à une logistique souple et performante développée à l’échelon national dans le respect des Bonnes Pratiques françaises de Tissus édictées par l’Agence de la Biomédecine (ex-Établissement Français des Greffes) et le respect de la loi Bioéthique.
La sélection est ensuite réalisée d’après les critères cliniques et biologiques issus des règles de sécurité sanitaire.
La traçabilité du tissu est assurée par un numéro d’identification unique attribué lors du prélèvement et conservé jusqu’à l’implantation du greffon PHOENIX®.
Le greffon osseux PHOENIX® est caractérisé par sa sécurité, sa facilité de conservation et d’utilisation, et son efficacité clinique prouvée et publiée.
Plus de 150 établissements de santé français sont aujourd'hui partenaires de TBF pour l'activité de recueil de têtes fémorales.
TBF Génie Tissulaire met en œuvre un traitement spécifique d’inactivation virale, de délipidation, de lyophilisation et une radiostérilisation proposant toutes les garanties possibles d'innocuité.
La production est effectuée en zones à atmosphère contrôlée de classes ISO6 & ISO7.
Les étapes de la transformation sont les suivantes :
• Découpe et élimination du cartilage et de l’os cortical de la tête fémorale pour permettre une bonne pénétration des solvants.
• Inactivation des virus et des prions : une alternance de traitements chimiques (bains de lavage et de rinçage) et mécaniques (découpe, fraisage et lavage sous haute pression) permet de nettoyer les travées osseuses et d’éliminer les parties scléreuses ou trop fragiles de l’os, ainsi que les parties molles et les insertions ligamentaires. Les solvants chimiques utilisés sont l’éthanol et le chloroforme pour la délipidation, le peroxyde d’hydrogène et l’hypochlorite de sodium. Ce dernier bain à 2% de chlore actif permet de se prémunir contre les prions : cette étape permet une inactivation totale des ATNC (agents transmissibles non conventionnels), comme le décrit l’instruction applicable au 1er janvier 2012 de la Direction Générale de la Santé (DGS). A l’issue du traitement, différents tests ont montré un tissu osseux intact, des taux de solvants résiduels quasi inexistants et un taux de lipides inférieur à 5 %.
• Lyophilisation ou cryo-sublimation afin de déshydrater le tissu osseux en profondeur de façon reproductible permettant de garantir une conservation à long terme, à température ambiante, des caractéristiques du tissu osseux.
• Conditionnement sous vide des copeaux et des poudres.
• Radio stérilisation gamma entre 25 et 32 kGy, validée selon la norme ISO 11137.
Ce procédé a pour finalité de nettoyer les travées osseuses et d’inactiver par des solvants chimiques les micro-organismes potentiels.
Cette inactivation a été démontrée par l’Institut Pasteur-Texcell sur des virus particulièrement résistants.
La certification ISO 9001 garantit une reproductibilité du procédé PHOENIX® grâce au système d’assurance qualité.
Plusieurs étapes de contrôle sont effectuées au cours du traitement et chaque greffon est contrôlé individuellement avant libération.
• L. Venet, M. Perriat, P. Jaby, T. Fortin ;
Intérêt de l'imagerie pour les greffes d'apposition allogéniques par tunnelisation
L'information dentaire, 2015.
• M. Isidori, T. Fortin ;
Etapes cliniques d'une reconstruction osseuse sous-sinusienne à l'aide de bouchons osseux impactés par voie crestale
Implant, 2014-20, 343-350.
• M. Perriat, C. Medard, C. Chavrier ;
Recherche d’une chirurgie implantaire à moindre invasivité, A propos d’un cas complexe d’édentement maxillaire 1ère partie : phase chirurgicale préimplantaire
Implant, vol 10 n°2, 2004.
• M. Brunel, C.Chavrier ;
Greffes d'apposition mandibulaires postérieures verticales par blocs osseux d'origine buccale
Implant, volume 9, Numéro 2 -2003.
• M. Perriat, C. Chavrier ;
Comblement sous-sinusien par la technique de cloisonnement à l’aide de greffon d’os cortical allogénique,
Implant, vol 8 n°2, 2002.
• S. Delpech ;
Descellement cotyloidien traité par allogreffe lyophilisée A propos de 25 cas, Thèse pour le doctorat en Médecine, Université de Picardie Jules Verne, Faculté de médecine d’Amiens, 2004, n°51.
• F. Borrione ;
Utilisation des greffes osseuses au cours des reprises de P.T.H. pour descellement,
Implantologie, fév 2004: 23-31.
• J.Caton, S.Eyrard, L.Barnouin ;
Suivi à 5 ans d'une banque de tissus osseux et de plus de 25 000 greffons impantés
Revue de Chirurgie Orthopédique et réparatrice de l'appareil moteur, vol.89 Octobre 2003
• C.Savornin, M.Caltran, P.Le Couteur, J-J. Jouan, P.Deroche, J-F Vinceneux, L .Barnouin ;
Reconstruction acétabulaire par allogreffe lors des reprises de prothède de hanche
médecine et armée, 2002, 30,3
• C.Savornin, M.Caltran, P.Le Couteur, J-J. Jouan, P.Deroche, J-F Vinceneux, L .Barnouin ;
Use of freeze-dried bone allografts in revision total hip arthroplasty, European Journal Orthopaedic Surgery Traumatology , 2002, 12:186-191.
• Barnouin L. ;
Les enjeux réglementaires d’une banque de tissus osseux,
La lettre de la stomatologie, n°14, 2002.
• Circulaire n° DGS/5C/dhos/Eé/2001/138 du 14 Mars 2001 relative aux précautions à observer lors de soins en vue de réduire les risques de transmission d’agents transmissibles non conventionnels.
NOR : MESP0130089C.
• Perriat M., Chavrier C. ;
Reconstruction osseuse implantaire à l’aide de greffons d’os allogénique,
Implant, vol 6 n°3, 2000.
• Batail R., Bruyère Garnier K., Rumelhart C. ;
Mechanical behaviour of human cancellous bone. Microbending of single trabeculae,
Archives of physiology and biochemistry, 1999.
• Bruyère-Granier K., Dumas R., Rumelhart C., Arlot M.E ;
Mechanical caracterization in shear of human femoral cancellous bone : torsion and shear tests,
Medical Engineering and Physics, 1999.
• Institut Pasteur Texcell ;
Etude de l’inactivation virale au cours d’un procédé de préparation de greffons osseux d’origine humaine.
Rapports 91/02/5144/01-A1 et 91/02/5144/02-A1, Paris, 1995.
• Mitton D. ;
Evaluation des propriétés mécaniques de greffons osseux d’origine humaine, lyophilisés et radiostérilisés,
DEA de GBM, INSA Lyon, 1994.
• F. Jolivot ;
Optimisation du volume osseux préimplantaire dans le secteur antérieur maxillaire: greffe autogène versus allogénique, Thèse pour le DE de docteur en chirurgie dentaire, Université C Bernard LYON1, U.F.R. d’odontologie, 2005, n°2005LYO1D048.
• Bardonnet R. ;
Evaluation dans un modèle poliovirus de l’inactivation virale lors de la préparation des greffons osseux d’origine humaine.
DES de pharmacie spécialisée (N°41-94), Lyon, 1994.
Autorisation de «Banque de tissus et procédés» n° BT/16/M/001 obtenue en janvier 2001 et reconduite régulièrement : obligatoire pour les activités de transformation, conservation, distribution et cession de tissus utilisés à des fins thérapeutiques.
• Sélection clinique des patients donneurs par les chirurgiens orthopédistes suivant le formulaire de l'Agence de la Biomédecine (anciennement Etablissement Français des Greffes) et aseptie du prélèvement.
• Sélection biologique effectuée sous la responsabilité d’un laboratoire de biologie agréé, indépendant. Un dépistage systématique recherche les infections par les virus HIV 1 & 2, HTLV, les hépatites B et C, la syphilis.
• Processus d’inactivation des virus résistants, validé par l’Institut Pasteur Texcell.
• Inactivation des prions, selon la circulaire en application depuis 2001.
• Radiostérilisation des greffons PHOENIX® selon la norme ISO 11137 (anciennement EN552)
• Maîtrise de la traçabilité du don à la pose : Entrées dans la base de donnée de TBF des fiches d’implantation retournées par les praticiens
• Biocompatibilité et sécurité des greffons PHOENIX® démontrées et validées par des organismes scientifiques reconnus : Biomatech, CNRS, Institut Pasteur-Texcell, LSEH, LMSo.
Les allogreffes PHOENIX sont constituées d'os allogénique. Elles offrent les propriétés de micro et macroporosité physiologiques naturelles de l’os spongieux humain.
Elles sont constituées d'os minéralisé et délipidé, permettant la colonisation immédiate des cellules et vaisseaux du patient pour une ostéointégration rapide.
Ces qualités ont été démontrées par TBF au cours d'une étude multicentrique, l'efficacité clinique est confirmée par les utilisateurs des greffons depuis 1994.
Poudre d'os spongieux PHOENIX®
Poudre d'os cortico-spongieux PHOENIX®
Blocs d'os spongieux PHOENIX®
Copeaux d'os spongieux PHOENIX®
Lamelles d'os cortico-spongieux PHOENIX®
Cas cliniques / Patients
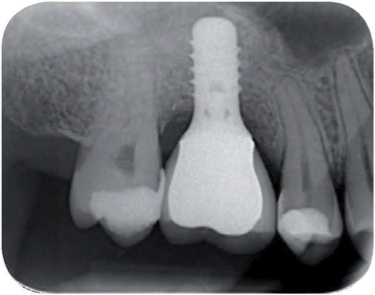
Coupe histologique réalisée sur biopsie prélevée 5 mois après greffe d'un sinus. Poudre d'os Phoenix.
• Implantologie / Parodontologie :
- Soulevé de sinus, épaississement de crête.
- Comblement divers : poche parodontale, alvéole, site péri-implantaire.
• Chirurgie Maxillo-faciale - produits complémentaires

Pour commander, contacter TBF pour toute demande d’information :
TBF Génie Tissulaire - 6 rue d'Italie - 69780 MIONS - France
Votre responsable commercial TBF / Groupe Lépine
Tél. : 04 72 68 69 09
Fax : 04 72 68 69 10
e-mail : contact@tbf-lab.com